거대 단백질인 헌팅틴 단백질의 아미노 말단에서 반복되는 글루타민 개수에 따라 헌팅틴 단백질의 구조가 달라지는 현상 관찰
생명과학과 송지준 교수 연구팀이 헌팅턴씨 병을 일으키는 원인인 헌팅틴 단백질의 구조를 규명하는 데 성공했다. 이번 연구는 하버드 의과대학 성인식 교수 연구팀과 공동으로 진행되었으며, 연구 결과는 지난 3월 22일 분자생물학 관련 학술지 <이라이프(eLife)>에 게재되었다.
유전성•퇴행성 뇌질환인 헌팅턴씨 병
헌팅턴씨 병(Huntington’s di-sease)은 알츠하이머병, 파킨슨병과 같은 퇴행성 뇌질환의 일종이다. 헌팅턴씨 병은 우성 유전으로 전달되는 유전성 질병으로, 발병 시기가 늦어 자신이 환자임을 알기 전에 자식을 낳아 유전자를 물려줄 가능성이 크다는 것이 특징이다. 헌팅턴씨 병은 주로 40대에서 50대에게서 나타나며, 15년 정도에 걸쳐 퇴행이 진행된다. 이 병에 걸린 환자들은 춤을 추는 것처럼 제어되지 않은 움직임을 보여 헌팅턴씨 병은 헌팅턴 무도병이라고도 불린다.
단백질 끝 글루타민 수가 발병 결정해
헌팅턴씨 병의 발병 여부는 헌팅틴(Huntingtin) 단백질의 아미노 말단(N-terminus)*에 있는 글루타민의 개수에 따라 결정된다. 정상적인 사람은 글루타민의 개수가 25개 내외로, 글루타민이 35개 이상으로 늘어나면 헌팅턴씨 병이 발병한다. 즉, 다양한 유전자가 발병에 관여하는 알츠하이머나 파킨슨병과 달리, 헌팅턴씨 병은 유전자 하나의 돌연변이에 의해 발병하는 단일유전자(mo-nogenic) 질병이다. 따라서 헌팅턴씨 병의 원인 규명 및 치료는 다른 퇴행성 질환보다 쉬울 것이라 여겨진다.
베일에 싸인 헌팅틴 단백질의 기능
하지만 헌팅턴씨 병의 발병 과정이나 헌팅틴 단백질에 대해서는 밝혀진 것이 많지 않다. 헌팅틴 단백질은 아미노산이 3,000개 이상 연결되어 만들어지는 거대 단백질로, 추출이 어려워 헌팅틴 단백질에 대한 연구가 거의 이루어지지 않았기 때문이다. 한편 그 기능에 관해서는, 헌팅틴 단백질이 없는 배아는 정상적으로 발생하지 못한다는 사실을 통해 헌팅틴 단백질이 발생 과정에서 중요하다는 것 정도만 알려졌다. 헌팅틴 단백질 말단 글루타민의 개수와 헌팅턴씨 병 환자에서 발견되는 파괴된 선조체(striatum)** 사이에 어떤 연관이 있는지에 대해서도 알려진 바가 거의 없다.
글루타민 수에 따라 구조 변형 일어나
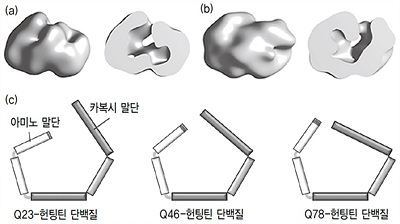
연구팀은 곤충 세포를 이용해 인간 헌팅틴 단백질을 정제한 뒤 그 구조를 규명하는 데 성공했다. 연구팀은 헌팅틴 단백질 말단의 폴리글루타민(polyglutamine)을 인식하기 위해 글루타민과 결합하는 항체를 이용했다. 전체 헌팅틴 단백질에서 말단 글루타민은 아미노산 몇십 개에 불과해 차지하는 비율이 낮아 관찰이 어렵기 때문이다. 이후 연구팀은 헌팅틴 단백질의 3차원 구조를 관찰해 글루타민의 개수가 헌팅틴 단백질의 구조에 영향을 미친다는 사실을 발견했다. 정상 헌팅틴 단백질은 글루타민이 있는 아미노 말단 쪽이 안쪽으로 휘어진 C형 구조다. 하지만 글루타민의 개수가 늘어날수록 아미노 말단 쪽이 펴지고, 반대쪽인 카복시 말단(C-terminus)이 안쪽으로 휘어진 구조로 변한다. 연구팀은 이와 같은 구조의 변화가 헌팅틴 단백질의 기능 변화를 일으킬 것으로 예상한다.
이번 연구는 지금까지 알려지지 않았던 헌팅틴 단백질의 구조를 규명했다는 점에서 큰 의의를 가진다. 송 교수는 “헌팅턴씨 병에 대해서는 앞으로도 연구해야 할 것이 많다”라며 “이번 연구가 헌팅턴씨 병의 발병 과정이나 치료법 연구에도 도움이 될 것으로 보인다”라고 밝혔다.

