[생명과학과 김학성 교수팀]말토스 결합 단백질의 알로스테릭 자리 이용해 조절한 구조 동역학적 특성과 단백질-생체 분자 해리도 사이 관계 밝혀내
우리 학교 생명과학과 김학성 교수팀이 유도형 맞춤 모델에 따른 단백질과 생체 분자의 해리 과정을 밝혀냈다. 이번 연구는 지난 4월 24일 자 <네이처 커뮤니케이션즈(Nature Communications)> 온라인판에게재되었다.
단백질의 특성을 설명하는 새로운 모델, 유도형 맞춤 모델
단백질은 우리 몸에서 다양한 생체 분자와 특이적으로 결합하며, 생명 현상을 유지하는데 중요한 역할을 한다. 이전까지는 단백질이 생체 분자와 특이적으로 결합하는 이 현상을 열쇠-자물쇠 모델로 설명했다. 단백질은 일정한 구조로 되어 있고, 이 구조에 적합한 다른 분자를 만났을 때 결합이 일어난다는 것이다. 그러나 핵자기공명법(NMR) 등의 기술이 개발되어 단백질을 실시간으로 관찰할 수 있게 되면서 단백질이 고정된 구조가 아닌 유동적인 구조로 되어있다는 것이 밝혀졌다. 이에 따라 단백질은 계속해서 구조가 변하며, 변화한 구조마다 특이적으로 결합하는 분자가 있다는 유도형 맞춤 모델이 새롭게 제시되었다.
구조 동역학적 에너지가 커야 생체 분자와 해리된다
그러나 유도형 맞춤 모델에서는 한 번 결합한 단백질과 분자가 어떻게 떨어지는지에 대해 알려진 바가 없었다. 유도형 맞춤 모델에서 단백질과 결합한 생체 분자가 떨어지는 메커니즘에는 여러 가지 가설이 있다. 그중 김 교수팀은 분자 자체의 고유한 구조 변화 에너지가 생체 분자와의 결합 에너지보다 크기 때문에 구조가 변하면서 생체 분자가 떨어진다는 가설에 초점을 맞췄다. 만일 이 가설이 맞다면 구조 동역학적인 에너지가 클수록 해리도도 커질 것이다.
알레스테릭 자리 조절해 단백질의 구조 동역학적 특성 바꿔
김 교수팀은 단백질의 알로스테릭 자리(allosteric site)를 조절함으로써 다양한 돌연변이를 만들어 단백질 고유의 구조 동역학적 에너지를 계산했다. 알로스테릭 자리는 단백질이 실제로 기능하는 자리가 아니지만 단백질의 활성에 영향을 미치는 특정 부위를 의미한다. 예를 들어 네 개의 헴과 글로빈 분자로 구성된 헤모글로빈의 한 알로스테릭 자리에 산소가 결합하면 나머지 세 개 분자들의 산소 결합 친화도가 감소한다. 김 교수팀은 말토스 결합 단백질(maltose binding protein)의 알로스테릭 자리를 이용했다. 말토스 결합 단백질의 알로스테릭 자리 아미노산을 다른 아미노산으로 치환하면 단백질의 구조 동역학적인 특성을 바꿀 수 있다.
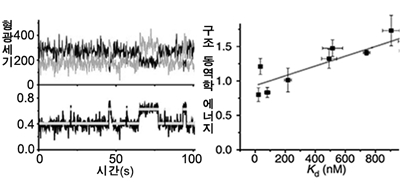
말토스 결합 단백질로 메커니즘 규명해
김 교수팀은 이 말토스 결합 단백질의 열렸다 닫혔다 하는 양 끝에 형광 물질을 부착했다. 한쪽에는 에너지 공여체를, 다른 한쪽에는 에너지 수용체를 부착한 뒤 현미경으로 이 두 물질을 들뜬 상태로 만들며 단백질을 관찰한다. 단백질이 닫혀 두 형광 물질 사이의 거리가 가까워지면 에너지 전이가 일어나 두 형광 물질에서 방출되는 형광의 비율이 달라진다. 김 교수팀은 이것을 전반사 형광 현미경으로 관찰한 결과를 시간에 대한 그래프로 그려 분석했다. 형광의 세기가 세졌다 약해지는 빈도가 높으면 단백질의 구조가 빠르게 변화한다는 뜻이므로 생체 분자가 잘 해리된다고 볼 수 있다. 결국 이 빈도가 높으면 해리도가 높은 것이며, 빈도가 낮으면 해리도가 낮은 것이다. 또, 김 교수팀은 분자 고유의 구조 동역학적인 에너지를 컴퓨터를 이용해 계산했다. 그 결과, 해리도가 증가할수록 분자 고유의 구조 동역학적인 에너지도 선형적으로 증가하는 값을 얻을 수 있었다. 이는 유도형 맞춤 모델에서 단백질의 구조 동역학적인 에너지가 단백질에서 생체분자가 떨어지는 원인이라는 것을 증명한 셈이다.
이번 연구는 이전까지 가설로 존재했던 유도형 맞춤 모델의 단백질-생체 분자 해리 메커니즘을 실제로 규명했다는 점에서 의미가 있다. 김 교수는 “단백질과 생체 분자가 떨어질 때 단백질의 구조 동역학적 특성이 핵심 역할을 한다는 사실을 새롭게 밝힌 것”이라고 설명했다.

