[물리학과 윤태영 교수팀]자기력 나노 집게를 사용해 생체막 융합 과정에서의 이력현상을 재현… 뇌 질환에 새로운 해결책 제시해줄 것으로 보여
우리 학교 물리학과 윤태영 교수팀이 자기력 나노 집게를 이용해 스네어(SNARE) 단백질의 숨겨진 중간구조와 작동원리를 단분자 수준으로 밝혔다. 이번 연구는 4월 16일 자 <네이처 커뮤니케이션즈(Na-ture Communications)>에 게재되었다.
생체막 융합의 핵심역할을 하는 스네어 단백질
우리가 자극에 반응하기 위해서는 신경세포가 신호를 받아 활성화되어야 한다. 이때 신경세포의 세포막에서 신경전달물질을 저장하고 있는 소낭이 방출된다. 이 과정을 위해서는 신경세포 내부에서 소낭과 세포막이 융합되어야 한다. 하지만 융합되는 중 소낭과 세포막이 같은 극성을 띠어 척력이 생기기 때문에 이를 이겨낼 힘이 필요하다. 이 과정에서 핵심적인 역할을 하는 것이 바로 스네어 단백질이다. 스네어 단백질은 소낭의 단백질 한 가닥과 세포막의 세 가닥이 결합한 것이다. 이 결합은 강해서 잘 풀리지 않는다. 이 결합력이 세포막과 소낭이 연결될 수 있게 한다.
기존 연구방법으론 생체막 융합 재현 불가능해
신경세포의 반응시간은 약 천 분의 일 초로 짧은 시간이다. 하지만 일반적인 방법으로는 신경세포의 반응을 시간 내에 마칠 수 없다. 학자들은 스네어 단백질이 짧은 시간 내에 반응을 가능하게 하는 핵심 역할을 한다고 예상했다. 생체막 융합과정에서 스네어 단백질에 힘이 걸리 며 소낭과 생체막을 연결한다. 하지만 지금까지는 스네어 단백질에 직접 힘을 가하지 못해 생체막 융합 과정에서의 스네어 단백질의 변화를 재현할 수 없었다. 지금까지는 열역학적 방법과 화학적 방법을 이용했지만, 단분자 수준의 정확한 작동원리는 밝힐 수 없었다.
자기력 나노 집게를 통해 실시간으로 단백질 구조 밝혀
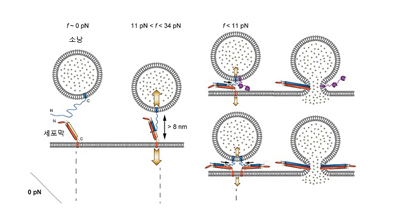
윤 교수팀은 자기력 나노집게를 사용하여 스네어 단백질에 힘을 가해 구조를 밝히는 데 성공했다. 연구팀은 현미경 시판에 DNA와 자성을 띈 구슬을 연결했다. 그리고 DNA 중간에 스네어 단백질 가닥을 부착했다. 또한, 윗부분에 2개의 영구자석의 극성을 반대로 배치해 자기장을 형성했다. 이를 자기력 나노집게라고 한다. 마이크로미터 크기인 구슬은 자기장에 의해 위로 당기는 힘을 받는다. 이때 구슬과 함께 DNA에 장력이 생겨 스네어 단백질의 간격이 벌어지게 된다. 이로써 생체막 융합 과정에서 스네어 단백질의 작용을 재현할 수 있게 되었다.
이력현상으로 작동하는 스네어 단백질
스네어 단백질에 힘이 걸리면 단백질의 간격이 늘어난다. 처음 준 힘 11pN에서 33pN의 힘으로 높이면 스네어 단백질의 간격이 벌어진다. 그런데 11pN의 힘이 되면 처음보다 늘어난 상태로 간격이 닫히지 않는다. 원래의 간격으로 돌아가려면 11pN보다 더 작은 힘을 줘야 한다. 이후 작은 힘을 주면 단백질 간격이 급격하게 줄어들어 닫히게 된다. 이를 강한 역학적 이력현상이라고 한다. 이력현상은 물리량이 그때의 물리 조건만으로는 결정되지 않고, 이전에 그 물질의 상태 변화과정에 의존하는 현상을 말한다. 연구팀은 이를 이용해 스네어 단백질의 단분자 수준의 작동원리를 규명하였다.
스네어 단백질의 작동원리를 통해 신경세포의 빠른 반응 이유를 규명해
생체막융합 반응의 정도는 세포막과 소낭에 붙는 스네어 단백질의 결합 간격으로 결정된다. 스네어 단백질은 세포막과 소낭이 합쳐지는 과정에서 힘에 의해 간격이 벌어지게 된다. 이 상태는 자기력 나노집게에서 분석했었던 33pN이 11pN으로 줄여져 초기 상태보다 단백질 간격이 늘어난 상태와 같다. 이후 힘을 더 낮춰주면 단백질의 간격이 급속하게 줄어든다. 그 결과 세포막과 소낭이 가까워져 막 융합이 일어나고 신경전달 물질이 방출된다. 이처럼 최소한으로 스네어 단백질 간격이 형성되어 신경전달물질이 방출되므로 마이크로초 수준의 빠른 생체막 융합 반응이 가능해진다.
세포막 융합기능은 알츠하이머병과 같은 퇴행성 뇌 질환이나 신경질환과 밀접하게 연관되어 있다. 스네어 단백질의 구조를 밝힌 것이 이러한 질병을 예방하고 치료법을 개발하는데 새로운 촉진제가 될 것으로 기대된다. 윤 교수는 “스네어 단백질이 결합하는 원리를 밝혔으니 결합을 푸는 NSF-α SNAP 단백질의 역할을 밝혀낼 예정이다”라고 추후 연구계획을 밝혔다.

