Structural basis for assembly and disassembly of the IGF/IGFBP/ALS ternary complex - 「Nature Communications」
우리 학교 의과학대학원 김호민 교수 연구팀이 지난 7월 30일 성장에 관여하는 인자의 구조와 메커니즘을 구명했다고 밝혔다. 연구팀이 연구한 인슐린 유사 성장 인자는 인슐린과 유사한 분자구조를 가진 호르몬으로, 신체 유지와 신진대사에 관여하며, 특히 태아 및 소아·청소년기 성장에 중요한 역할을 한다. 이러한 인슐린 유사 성장 인자는 신체에서 주로 삼중 복합체를 형성한 상태로 존재하는데, 연구팀의 연구 핵심은 삼중 복합체의 3차원 분자구조를 구명하고, 그 조립 및 분해 메커니즘을 제안한 것에 있다. 이번 연구 결과는 성장과 대사에 관련된 다양한 질병에 대한 이해를 높여, 진단·치료제 개발에 이바지할 것으로 기대된다.
성장과 대사를 조절하는 인슐린 유사 성장 인자
인슐린 유사 성장 인자(Insulin-like Growth Factor, IGF)는 다양한 조직 세포막에 분포하는 인슐린 유사 성장 인자 수용체를 활성화해 세포분열, 세포 증식·분화와 생존을 조절한다.
인슐린 유사 성장 인자의 결핍은 지연된 발육과 같은 성장기 발달 장애를 유발하며, 과잉은 말단 비대증과 다양한 성인병 위험도를 증가시킨다. 이외에도 인슐린 유사 성장 인자는 인슐린과 협동하여 혈당을 조절하거나 종양의 발생에도 관여함이 알려져 있다.
인슐린 유사 성장 인자의 삼중 복합체 형성
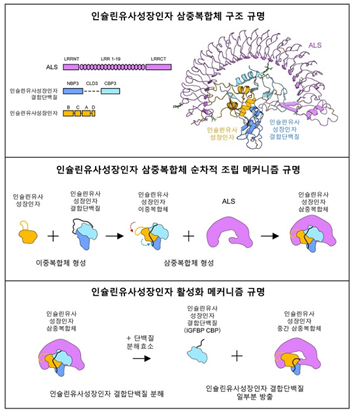
인슐린 유사 성장 인자는 단독으로는 매우 불안정하여 체내 반감기가 10분이 채 되지 않는다. 때문에 인슐린 유사 성장 인자의 70% 이상은 결합 단백질들인 IGFBP (IGF Binding Protein), ALS (Acid labile subunit)과 결합하여 안정한 삼중 복합체 형태로 존재한다. 삼중 복합체를 형성하면 체내에서 202시간 이상 머무는 것이 가능하기 때문이다. 복합체를 형성하는 두 가지 단백질(IGFBP, ALS)은 인슐린 유사 성장 인자의 생물학적 작용을 조절하는 기능을 수행한다. 두 단백질의 조절로 인슐린 유사 성장 인자 삼중 복합체(IGF1/IGFBP/ALS)는 생체 내에서 아주 정교하게 조립되고 혈중 농도가 알맞게 유지된다. 인슐린 유사 성장인자가 필요할 시에는 복합체가 분해되어 인슐린 유사 성장 인자가 적절하게 성장 조절 효과를 나타낼 수 있게 된다. 이 때문에 인슐린 유사 성장 인자와 이들 결합단백질의 혈중 농도는 성장호르몬결핍증, ALS 결핍증과 같은 성장 관련 질환을 평가하는데 검사항목으로도 이용되고 있다. 연구팀의 연구 대상 또한 이러한 삼중 복합체이다.
연구팀의 연구는
연구팀은 삼중 복합체의 구조와 분해 과정, 조립 과정을 구명했다. 먼저, 연구팀은 초저온투과전자현미경(cryo-EM)을 활용하여 삼중 복합체의 3차원 분자 구조를 구명했다. 특히, 인슐린 유사 성장 인자가 IGFBP에 둘러싸여 이중복합체를 이루고, 말발굽 모양의 ALS이 이중복합체를 한 번 더 감싸는 안정된 구조로 인해 인슐린 유사 성장 인자가 체내에서 쉽게 분해되지 않는 것을 발견했다.
이후, 다양한 생화학적 실험을 통해 삼중 복합체가 순차적으로 조립되는 과정과, 삼중 복합체가 분해되어 인슐린 유사 성장 인자가 제 기능을 하도록 하는 과정의 메커니즘을 구명했다. 인슐린 유사 성장 인자 삼중 복합체에 포함된 IGFBP이 생체 내 단백질분해효소에 의해 잘리면, IGFBP의 C-말단이 떨어져 나가면서 불안정한 중간 삼중 복합체가 형성된다. 이 과정이 인슐린 유사 성장 인자가 활성을 나타내게 하는 핵심 과정임을 새롭게 발견했다.
난관을 해결하며 연구가 확장돼
연구팀은 처음에 삼중 복합체에 포함된 IGFBP의 구조를 구명하는 데 어려움을 겪었다고 밝혔다. IGFBP가 형성하는 고리가 안정적이지 않고 계속 움직여 구조를 구명하기가 쉽지 않았던 것이다. 연구팀은 해당 구조에 관한 연구를 이어가며, 여러 IGFBP들의 서열을 비교해보면 특이하게도 그 유동적인 부분의 아미노산 서열이 서로 많이 다르다는 것을 발견했다.
구조 구명과 더불어 추가적인 생화학적 실험을 진행한 결과, 연구팀은 해당 부분이 분해와 조립에 중요한 역할을 한다는 사실을 입증하는 데 성공했다. 이에 관해 연구를 주도한 김효진 박사과정은 “구조 구명이 쉽지 않았던 것이 전화위복이 아니었나 생각한다”라고 이야기를 전했다.

