생명과학과 전상용 교수, 화학과 이희승 교수 공동 연구팀 : Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy - 「Advanced Materials」
우리 학교 생명과학과 전상용 교수와 화학과 이희승 교수 공동 연구팀이 지난달 12일 인공탄수화물기반 나노입자 라이브러리 플랫폼을 이용해 항암치료용 나노의약 개발에 성공했다고 밝혔다.
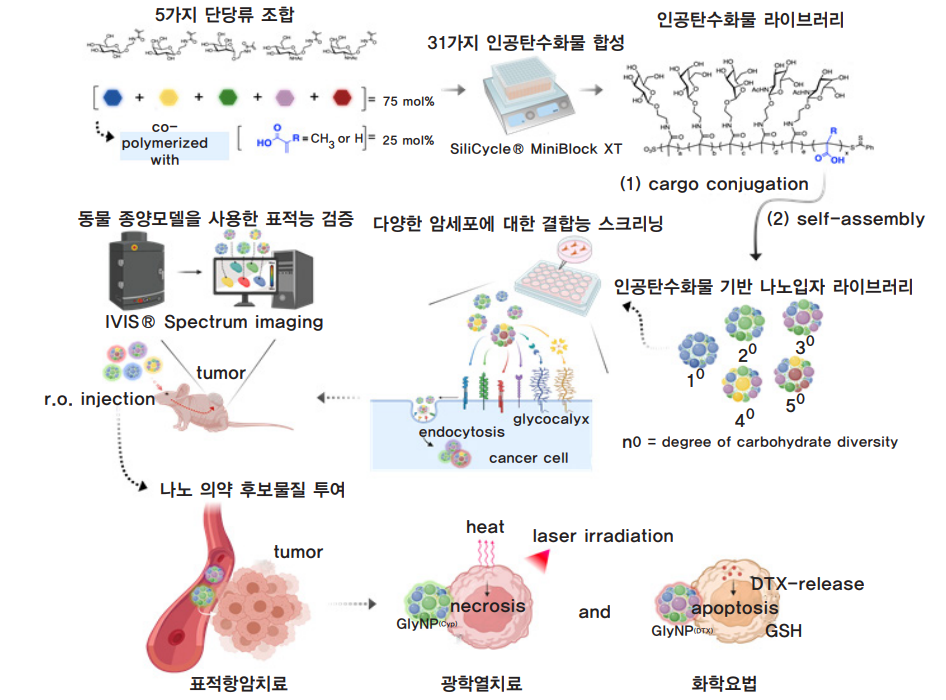
인공탄수화물 기반 나노입자 라이브러리의 구축
세포막은 다양한 형태의 당사슬(glycan) 집합체로 구성된 글리코칼릭스(glycocalyx)에 둘러싸여 있다. 특히 글리코칼릭스의 탄수화물 부분은 세포 신호와 세포부착 등 다양한 과정에서 중요한 역할을 한다. 대부분의 암세포는 표면에 비정상적인 글리코칼릭스 구조를 갖는다. 이들은 탄수화물-탄수화물 혹은 탄수화물-수용체 간의 결합 작용을 통해 신호 전달을 매개하고 종양의 전이와 진행에 관여한다. 이러한 결합 작용들은 일반적으로 하나의 당이 아니라 여러 당류로 구성된 당사슬체를 통해 이루어진다. 연구팀은 이 점에 착안하여 암세포의 글리코칼릭스를 모방하며, 그와 상호적으로 결합할 수 있는 당 조합을 발굴하고자 하였다.
이에 따라 연구팀은 자연에 가장 흔히 존재하는 5가지 단당류들을 조합하여 31가지의 인공탄수화물 후보군들을 합성한 뒤, 최종적으로 인공탄수화물 기반 나노입자 라이브러리를 구축했다. 그런 다음 구축된 라이브러리로 다양한 암세포와 동물 종양 모델에서 스크리닝을 진행하여 표적 암세포에 특이적으로 결합하는 나노입자 후보군을 선별해냈다. 선별된 후보군에는 항암제를 선적하여 광열 치료와 화학요법을 통해 목표 종양을 효과적으로 치료할 수 있음을 증명했다.
인공탄수화물 기반 나노입자, GlyNP
이렇게 선별된 인공탄수화물 기반 나노입자(glyconanoparticle, GlyNP)는 다양한 암종에 표적능을 보였다. 지금까지 개발된 나노입자 시스템들은 보체*를 활성화해 면역반응을 자극하는 경우가 많아, 예상치 못한 부작용들이 발생하기도 했다. 그러나 이번 연구에서 개발한 GlyNP 시스템은 보체에 반응성이 적어 면역활성화 가능성이 낮다. 또한 테스트해본 GlyNP들은 당 조합과 무관하게 체내 순환 시간이 비슷했다. 하나의 당으로 구성된 나노입자보다 여러 종류의 당을 조합한 GlyNP가 더욱 효과적인 암 표적능을 보인다는 사실 역시 주목할 점이다. 특히 이번 연구 결과는 체외에서 진행되었던 기존 연구들과는 달리 생체 내에서도 증명되어 의미가 크다.
GlyNP 플랫폼의 응용 가능성
이번 연구에서 개발한 인공탄수화물 기반 나노입자 플랫폼을 활용할 수 있는 분야는 무궁무진하다. 먼저 리간드**의 결합 능력을 최적화하여 선별된 후보군의 암 표적능을 더욱 향상할 수 있다. 기존에 사용된 다섯 가지 단당류 외에 시알산이나 과당과 같은 다른 당류들을 조합하여 다양한 당 조합 라이브러리를 구축할 수도 있다. 암이 아닌 다른 질병이나 특정 장기를 표적으로 하는 나노의약을 개발하는 일에도 GlyNP 플랫폼을 적용할 수 있다. 연구팀은 이와 관련하여 후속 연구를 진행 중이라고 밝히기도 했다.
이번 연구를 주도한 황창희 박사과정은 전 교수와 공동연구팀에 감사를 전하는 한편, “우리 학교는 연구와 공부를 하기에 정말 좋은 환경이다. 완벽하지는 않지만, 어디에나 부족하고 아쉬운 부분이 존재한다고 생각한다. 학생들이 자부심을 가지고 주어진 환경을 잘 활용하여 꿈을 이루어 나갔으면 좋겠다”고 전했다.
보체*
병원체를 제거하기 위해 면역 작용과 식세포 작용의 기능을 보충하는 물질
리간드**
생체 분자와 복합체를 형성하는 물질

