(논문명) Mechanistic approaches for chemically modifying the coordination sphere of copper-amyloid ... - 'PNAS'
화학과 임미희 교수 연구팀이 산소를 이용해 알츠하이머병 유발 단백질로 인한 독성을 개선하는 화합물을 개발했다. 이번 연구는 지난 2월 27일 <미국국립과학원회보(PNAS)>에 게재됐다.
구리 이온이 알츠하이머병 유발해
우리 몸의 다른 부위에 비해 뇌에는 높은 농도의 금속 이온이 존재한다. 금속 이온은 여러 가지 효소들의 보조자 역할을 수행하며 신호 전달, 산화 대사, 항산화 방어와 같은 기능에 관여한다. 하지만 금속 이온의 항상성이 유지되지 않으면 효소 활성이 감소하고, 단백질 응집 및 산화 스트레스가 증가해 신경 변성을 유발하는 등 병리학적 원인이 되기도 한다. 알츠하이머병의 발병 과정은 아직 완전하게 규명되지는 않았지만, 아밀로이드 베타가 발병에 중요하게 작용한다고 알려져 있으며 여기에 구리 이온이 배위 결합*을 한다는 것이 확인되었다. 아밀로이드 베타는 펩타이드의 일종으로 응집을 통해 신경성 플라크를 형성하며, 일련의 과정을 통해 신경세포의 사멸에 관여한다. 금속 이온의 항상성이 무너지면 구리 이온은 아밀로이드 베타에 결합한다. 그리고 펩타이드 N 말단의 단백질 접힘으로 인한 응집을 촉진하거나, 화학 반응을 통해 활성 산소종을 발생시켜 신경세포에 대한 독성을 유발한다. 이러한 작용을 방지하기 위해 구리-아밀로이드 베타 복합체를 대상으로 한 연구가 활발하게 진행되고 있다.
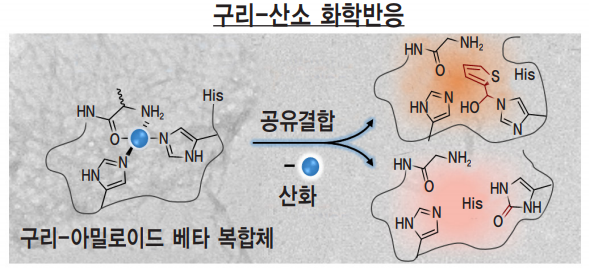
L1은 구리-아밀로이드 베타 복합체에 작용해 중심의 구리를 환원시킨다. 이후 구리-산소 화학반응으로 공유결합이나 산화가 일어나 복합체의 구조가 변화하게 된다.
ⓒ임미희 교수 제공
구리-산소 화학반응으로 복합체 변형
연구팀은 구리-아밀로이드 베타 복합체의 화학적 메커니즘을 고려한 ‘배위권 이중 변형 기법’의 구현을 목표로 화학 물질을 설계했다. 설계를 기반으로 구리-아밀로이드 베타 복합체의 배위 결합 영역인 배위권을 표적으로 하는 화합물 L1을 제작해 그 작용 과정을 확인했다. 이 물질은 구리와 아밀로이드 베타의 배위 결합에 참여하는 히스티딘 잔기(His14)를 변형시킨다. 자세한 과정을 살펴보면 우선 L1이 구리-아밀로이드 베타 복합체의 중심에 있는 구리(II)를 구리(I)로 환원시킨다. 환원된 구리-아밀로이드 베타 복합체는 공기 중의 산소와 구리-산소 화학반응을 일으킨다. 이 반응을 통해 His14에 대한 공유 결합이 형성되어 복합체의 구조가 변형되거나, His14의 산화가 일어나 변형이 일어나기도 한다.
변형으로 응집과 세포 독성 감소시켜
연구팀은 실험을 통해 L1을 이용한 배위권의 변형이 구리와 아밀로이드 베타의 결합을 효과적으로 막아 아밀로이드 베타의 응집이 줄어듦을 확인했다. 또한, 구리-아밀로이드 베타 복합체의 중심인 구리의 산화/환원 반응으로 생성되는 활성 산소종**도 줄어들었다. L1을 이용한 변형은 기존의 기법에 비해 구리-아밀로이드 베타 복합체로 인한 세포 독성을 더욱 효과적으로 회복시켰다는 점에서 향후 알츠하이머병의 치료에 활용될 수 있는 가능성이 크다.
이번 연구에 제1 저자로 참여한 한지연 박사과정은 “이번 연구에서는 다양한 변수를 정교하게 조절해 L1의 표적 특이성과 작용 원리를 분자 수준에서 밝힘으로써, 구리-산소 화학 반응을 통해 아밀로이드 베타의 구리 배위권을 변형시키는 메커니즘을 최초로 밝혀냈다”라고 연구 의의를 전했다. 이어 “이번에 개발한 기법은 알츠하이머병뿐만 아니라, 아밀로이드성 단백질 변형으로 인해 나타나는 다른 퇴행성 뇌 질환 치료를 위한 물질 개발에도 적용될 수 있을 것”이라며 앞으로의 가능성을 밝혔다.
배위 결합*
두 원자가 결합할 때 한 원자가 다른 원자에게 비공유 전자쌍을 형식적으로 제공하는 결합.
활성 산소종**
주변 조직을 공격하고 세포를 훼손하는 산화력이 강한 물질.

