나노바디를 연결자 부위에서 분리해 가역적으로 활성 제거 후, 마그넷 단백질 접합해 특정 파장의 빛을 받으면 재결합하도록 설계
생명과학과 허원도 교수 연구팀이 빛으로 항체를 활성화한 후 특정 단백질을 억제하도록 만드는 광유전학 기술을 개발했다. 이번 연구는 지난 10월 15일 <네이처 메소드(Nature Methods)>에 게재됐다.
나노바디의 활성을 가역적으로 제거
광유전학은 특정 파장의 빛에 반응하는 단백질을 이용해 연구하는 생명과학의 한 분야이다. 항체는 높은 정확도와 결합력을 가지고 목표 항원*을 인지하는 물질로 생명과학 전반에 걸쳐 이용되는데, 이번 연구에서는 빛을 이용해 항체의 활성을 조절하는 기술인 옵토바디(Optobody, Optogenetically Activated Intracellular Antibody)를 개발했다.
실험에는 항체로 작용할 수 있는 가장 작은 물질인 나노바디가 사용되었다. 나노바디는 구조를 이루는 베타 샌드위치 부위와 이를 잇는 여러 연결자 부위로 구성되는데, 연결 부위 중 목표 물질과 직접 상호작용하는 부위는 특별히 CDR이라 불린다. 연구팀은 CDR이 아닌 연결부위를 골라 나노바디를 두 조각으로 나눠 활성을 제한했다. 그리고 각 조각에 라파마이신이라는 화학물질에 의해 서로 결합하는 두 단백질을 부착했고, 라파마이신을 투여했을 때 나노바디 조각이 다시 결합하며 활성화 되는 것을 확인했다. 이 항체 조각은 빛으로 활성이 조절되는 옵토바디에 대응되는 케모바디(Chemobody, Chemically Activated Intracellular Antibody)라고 불린다.
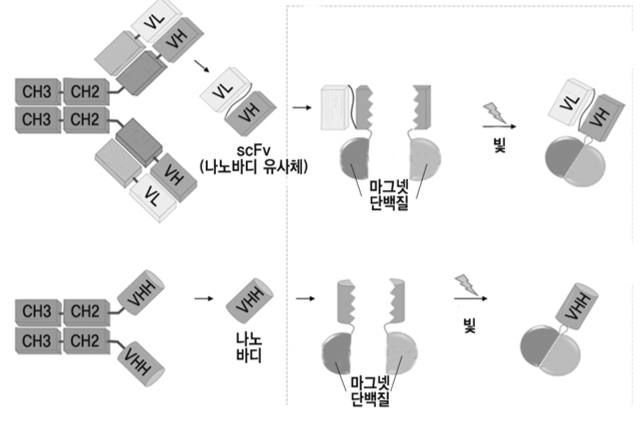
항체의 끝 부분에 해당하는 나노바디 조각에 마그넷 단백질을 부착한 옵토바디의 모습. 빛을 받으면 나노바디 조각이 재결합하며 다시 활성화된다. (ⓒ허원도 교수 제공)
목표에 특이적으로 결합하는 항체
연구팀은 케모바디를 통해 발견한 나노바디의 가역적인 활성 변화를 이용해 옵토바디를 합성했다. 특정 파장의 빛이 조사되면 서로 결합하는 마그넷 단백질을 나노바디의 각 조각에 부착했고, 빛을 통해 재조합됐을 때 다시 활성화 되는 것을 확인한 것이다. 생화학적 활성을 갖지 않지만, 형광을 나타내 표지 물질로 널리 활용되는 GFP(Green Fluorescent Protein)에 결합하는 나노바디로 우선 옵토바디의 가능성을 보인 뒤, 생화학적 활성을 갖는 다른 단백질에 대한 나노바디로도 옵토바디를 성공적으로 개발했다.
항체는 실제 생명체가 면역 작용을 위해 만드는 물질로, 실질적으로 모든 물질에 대해 특이적으로 결합하는 항체를 만들 수 있다. 따라서 항체는 목표 물질의 양을 측정하는 표지로 사용할 수 있고, 결합하는 위치를 조정해 목표 물질을 비활성화시킬 수 있다. 빛을 통해 항체의 활성을 조절하는 옵토바디는 항체의 범용적인 성격을 극대화한 도구로, 원하는 시점에 원하는 목표 물질의 활성을 제거해 생체 현상을 이해하는데 널리 사용될 수 있다. 화학물질을 사용하지 않고 빛으로 활성을 조절하는 광유전학적 방법은 화학 물질로 인한 부작용을 없앨 수 있기에 추가적인 장점을 가진다.
기존 항체 관련 연구는 여러 종류의 항원에 작용하는 항체 개발에 초점을 두었다면, 이번 연구는 항체의 활성을 조절했다는 차별점을 가진다. 이번 연구에 제1 저자로 참여한 유다슬이 박사과정은 “이전에는 항체의 활성화를 직접 조절할 수 있는 방법이 없었는데, 화학물질투여와 빛의 조사라는 간단한 조작으로 항체 활성을 조정해 여러 연구에 활용할 가능성을 열었다”고 연구의 의의를 밝혔다.
항원*
항체가 특이적으로 결합하는 목표 물질. 본래 체내에 침입한 외부 물질로, 생명체는 이에 대항하기 위해 항원의 모양을 인식해 결합하는 항체를 만든다.

