라디칼 반응으로 아미노산과 탄소결합 일으켜 변형 단백질 합성… 다양한 질병의 원인 규명과 신약 개발에 도움될 것으로 기대
화학과 박희성 교수, 이희윤 교수 공동 연구팀이 암과 치매 등 각종 질병을 유발하는 비정상적인 단백질 변형을 직접 구현할 수 있는 기술을 개발했다. 이번 연구 결과는 <사이언스(Science)> 9월 29일 자 온라인판에 게재됐다.
생체 기능에 관여하는 단백질 변형
신체의 기본 단위인 세포에는 약 2만여 개의 유전자가 있다. 또한, 단백질이 만들어진 후엔 다양한 단백질 변형이 일어나므로, 이로부터 만들어지는 단백질의 종류는 100만 종 이상으로 추정된다. 현재 인산화, 당화, 아세틸화, 메틸화 등 200여 가지의 단백질 변형 방법이 알려져 있으며, 정상적으로 변형된 단백질은 생체 내에서 세포 신호 전달, 성장 등 신진대사 활동에 중요한 역할을 한다.
비정상적 변형은 많은 질병을 유발해
그러나 유전적, 환경적 요인으로 인해 단백질 변형이 비정상적으로 일어나면, 세포의 대사활동과 신호전달 시스템이 손상돼 세포의 무한 분열을 초래하기도 한다. 세포의 무한 분열은 각종 암과 치매를 일으키는 퇴행성 신경질환이나 고혈압, 당뇨, 동맥경화를 포함한 각종 만성질환을 유발하므로 위험하다.
단백질 변형을 직접 구현하는 신기술
이전에는 이렇게 위험성을 갖고 있는 비정상적인 변형 단백질을 구현할 수 있는 개발 기술이 존재하지 않아 각종 질병의 원인을 규명하고 신약을 개발하는 데 어려움이 많았다. 이에 연구팀은 인산화, 당화, 아세틸화 등과 같은 단백질 변형의 원인을 직접 구현해, 비정상적인 변형 단백질을 인위적으로 합성할 수 있는 기술을 개발했다. 200만여 종이 넘는 변형 단백질 중에서 질병의 원인이 되는 단백질을 찾아내는 것보다, 원인으로 추측되는 유력한 변형 단백질을 직접 합성해 연구하는 것이 훨씬 효율적이기 때문이다.
라디칼 반응으로 변형 단백질 합성해
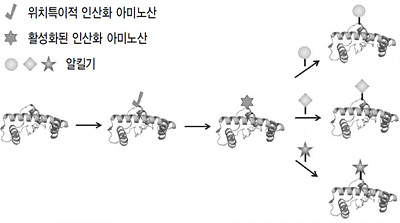
연구팀은 다음과 같은 방식으로 단백질 변형을 구현했다. 먼저 연구하고자 하는 단백질의 원하는 위치에 있는 아미노산을 인산화 아미노산으로 치환해 변형을 일으킬 부분을 표지한다. 그 후, pH를 높이는 등의 방식으로 치환한 인산화 아미노산을 활성화한다. 활성화된 인산화 아미노산은 탄소결합을 할 수 있는 구조로 바뀐다. 여기에 여러 종류의 알킬기(alkyl group)*를 가진 화합물과 라디칼 반응(radical reaction)**을 일으키면 알킬기와 아미노산 사이에 탄소결합이 이루어져 변형 단백질을 합성할 수 있다. 이때 알킬기의 종류에 따라 다양한 변형 단백질을 구현할 수 있다. 연구팀의 방식을 이용하면 자연계에 존재하는 것보다 더 다양한 종류의 변형 단백질을 만들 수 있다.
질병 원인 규명에 도움될 것으로 전망
이번 연구는 변형 단백질을 직접 만들어 지금까지 밝혀지지 않았던 질병의 직접적인 원인을 규명할 수 있다는 의의가 있다. 또한, 원하는 만큼 변형 단백질을 만들 수 있으므로, 질병을 치료하는 신약 개발 연구에도 많은 도움이 될 수 있다. 연구팀의 신기술을 이용하면 암, 치매와 같은 질병의 치료제 개발 속도가 빨라질 뿐만 아니라, 치료제로 인해 발생할 수 있는 부작용을 최소화 할 수 있다.
박 교수는 “질병을 유발하는 단백질은 많이 알려졌지만, 지금까지는 그것을 만들지 못해서 제대로 원인을 탐색하지 못했었다”라고 밝혔다. 또한, “이번 신기술을 이용해 신약 개발을 목표로, 암 전이를 일으키는 변형 단백질을 연구할 계획이다”라고 추후 연구 계획을 밝혔다.
알킬기*
사슬모양 포화탄화수소에서 1개의 수소 원자를 제외한 나머지 원자단.
라디칼 반응**
자유라디칼의 재결합에 의해 진행되는 반응.
곽대현 기자
nubdigi7@kaist.ac.kr

