[의과학대학원 김호민 교수팀]CryoEM이용해 밝혀낸 Rpt6 카르복실기 말단과 α2~3 구멍 결합 메커니즘으로 암세포 분열 억제하는 신약 개발에 기여해
우리 학교 의과학대학원 김호민 교수팀이 저온전자현미경관찰법(CryoEM)을 이용해 프로테아좀(Proteasome)의 형성 과정을 밝혀냈다. 이번 연구는 세계 최고 권위 학술지인 <네이처(Nature)> 온라인 판에 5월 6일자로 게재되었다.
세포 내 단백질을 분해하는 프로테아좀
세포 내 필요 없는 단백질을 없애는 과정은 단백질을 만드는 것 만큼 중요하다. 이런 단백질들을 분해하는 효소는 프로테아좀이다. 프로테아좀은 60개 이상의 단백질이 모여 만들어진다. 프로테아좀은 단백질을 분해하는 20S CP(Core Particle) 단백질과 분해할 단백질을 인지하는 19S RP(Regula-tory Particle) 단백질로 구성된다. 20S는 원통 모양이며 원통 안쪽에서만 단백질을 분해한다. 20S의 양 끝에 19S가 붙는다. 19S에는 단백질이 통과하는 입구가 있다. 분해되어야 할 단백질에는 유비퀴틴(Ubiquitin) 등 표지 단백질이 붙어있다. 19S는 유비퀴틴을 인식해 단백질을 20S 안으로 밀어 넣는다.
단백질결정학으로는 프로테아좀 형성 과정 밝히기 어려워
이전에는 프로테아좀 연구에 단백질결정학을 이용했다. 단백질결정학은 X선 등을 이용해 단백질의 결정 구조를 밝혀내는 방법이다. 프로테아좀은 다양한 조합의 단백질이 모여 형성된 효소이기 때문에 100 종류가 넘는다. 단백질결정학으로 단백질 구조를 알아내기 위해서는 한 종류의 프로테아좀이 다량 필요하다. 하지만 얻을 수 있는 프로테아좀은 양도 적을뿐더러 결정을 만드는 것조차 어렵다. 이런 이유 때문에 지금까지 프로테아좀의 형성 과정을 관찰하지 못했다.
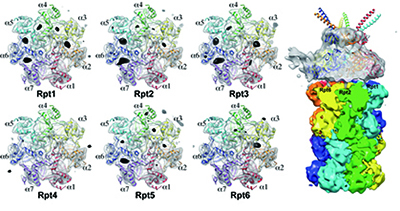
국내 최초로 CryoEM이용해 프로테아좀 형성 원리 밝혀
이런 한계점을 극복하기 위해 김 교수팀은 국내 최초로 CryoEM을 사용했다. CryoEM은 얼린 시료를 전자 현미경으로 보는 방법이다. 단백질결정학보다 분해능은 떨어지지만, 결정을 만드는데 걸리는 시간이 짧고 많은 샘플을 필요로 하지 않아 실험하기 쉽다. 또한 실제 기능을 하는 단백질의 구조를 볼 수 있다는 장점도 있다. 단백질이 물에 용해되어 있는 지 아닌 지는 그 구조에 영향을 미친다. 생체 내에서 작용하는 대부분의 단백질은 물에 녹아있기 때문에 물에 녹여 얼린 시료는 생체 내에서 존재하는 단백질과 비슷한 구조를 지닐 수 있는 것이다.
19S와 20S의 결합 과정, Rpt6와 α2~3구멍 중요해
김 교수팀은 CryoEM을 사용해 세계 최초로 19S와 20S가 결합하는 과정을 규명했다. 20S의 위에는 α1에서 α7까지 7개의 단백질이, 19S 아래에는 Rpt1에서 Rpt6까지 6개의 단백질이 있다. 이 단백질들은 20S와 19S가 붙는 표면에 있다. α 단백질 사이에는 구멍이 있어 Rpt의 카르복실기 말단과 결합한다. 이때 Rpt와 α 단백질이 결합하는 위치는 항상 같다. 결합 위치가 프로테아좀의 기능에 매우 중요하기 때문이다. 결합 위치가 항상 같은 이유는 Rpt 6의 결합에 있다. Rpt6는 카르복실기 말단은 α2~3 구멍에만 결합한다. 이 결합이 닻 같은 역할을 해 나머지 단백질을 알맞은 자리에 위치하게 한다. 이 결합은 다른 Rpt와 α구멍과의 결합을 촉진한다. 또한, 어떤 Rpt와 α 구멍이 결합하느냐에 따라 프로테아좀의 입구가 열리고 닫힌다. 19S와 20S가 결합한 후 Rpt2는 α3~4 구멍에, Rpt5는 α5~6 구멍에 결합하면 프로테아좀의 입구가 열린다.
이번 연구 결과는 새로운 항암물질 개발에 도움을 줄 수 있을 것으로 전망된다. 암세포에서는 단백질 생성과 분해가 빠르게 진행된다. 따라서 프로테아좀의 역할은 중요하다. 프로테아좀의 형성을 저해하면 암세포 분열을 억제할 수 있다. 김 교수는 “질병 관련 단백질의 구조를 알면 병리생리학적 메커니즘 이해 및 신약개발에 많은 기여를 할 수 있다”라며 “다양한 질병 관련 단백질복합체의 구조 연구를 수행할 예정이다”라고 밝혔다.

